¿Qué es?
Un concepto esencial de la termodinámica es el de sistema macroscópico, que se define como un conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable.El estado de un sistema macroscópico en equilibrio puede describirse mediante propiedades medibles como la temperatura, la presión o el volumen, que se conocen como variables termodinámicas.Es posible identificar y relacionar entre sí muchas otras variables (como la densidad, el calor específico, la compresibilidad o el coeficiente de expansión térmica), con lo que se obtiene una descripción más completa de un sistema y de su relación con el entorno.
Iso?
Ejemplo:
Isotérmico: proceso a temperatura constante
Isobárico: proceso a presión constante
Isométrico o isocórico: proceso a volumen constante
Isoentálpico: proceso a entalpía constante
Isoentrópico: proceso a entropía constante
Proceso Isotérmico
Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas:
Q = W.
Un buen ejemplo es la evaporación del agua o la fusión del hielo porque su temperatura es constante.
Proceso Isobárico
Este proceso ocurre a presión constante. La Primera Ley de la Termodinámica, para este caso, queda expresada como sigue:
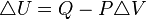 ,
,Donde:
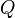 = Calor transferido.
= Calor transferido.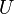 = Energía interna.
= Energía interna.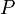 = Presión.
= Presión. = Volumen.
= Volumen.
Es la ebullición del agua en un recipiente abierto. Como el
contenedor está abierto, el proceso se efectúa a presión atmosférica constante.
En el punto de ebullición, la temperatura del agua no aumenta con la adición de
calor, en lugar de esto, hay un cambio de fase de agua a vapor.
En un diagrama P-V, un proceso isobárico aparece como una línea
horizontal. Si la presión no cambia
durante un proceso, se dice que éste es isobárico.
Proceso Isocórico
Proceso isométrico o Isocórico: durante este proceso el volumen es constante, el gas absorbe una cantidad de calor, aumentando por ende su temperatura hasta un valor final o en caso contrario; un gas se enfría desde una temperatura inicial hasta una
temperatura final manteniendo su volumen constante y disipando una cantidad de calor.
W=0
Un proceso que se efectúa a volumen constante sin que haya ningún desplazamiento, el trabajo hecho por el sistema es cero. Es decir, en un proceso isocórico no hay trabajo realizando por el sistema. Y no se adiciona calor al sistema que ocasione un incremento de su energía interna.
Ejemplo:
El proceso térmico que se desarrolla en una olla presión de uso doméstico, desde el momento que se coloca al fuego hasta que escapa por primera vez aire a través de la válvula, corresponde a un proceso a volumen constante
Proceso Adiabático
El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar que se consiga variar la temperatura del aire y su humedad relativa.
El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.
En otras palabras se considera proceso adiabático a un sistema especial en el cual no se pierde ni tampoco se gana energía calorífica. Esto viene definido segun la primera ley de termodinámica describiendo que Q=0
Si se relaciona el tema del proceso adiabático con las ondas, se debe tener en cuenta que el proceso o carácter adiabático solo se produce en las ondas longitudinales.
Ejemplo
Pajaro Bebedor




No hay comentarios:
Publicar un comentario