Un Gas?
Se denomina gas al estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas intereaccionan sólo débilmente entre sí, sin formar enlaces moleculares adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta energía cinética) . Los gases son fluidosaltamente compresibles, que experimentan grandes cambios de densidad con la presión y la temperatura. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
Los gases ocupan completamente el volumen del recipiente que los contiene.
Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno el nitrógeno el cloro el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas , por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa.

Gases Ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura. La causa de la naturaleza del gas se encuentra en sus moléculas, muy separadas unas de otras y con movimientos aleatorios entre si. Al igual que ocurre con los otros dos estados de la materia, el gas también puede transformarse (en líquido) si se somete a temperaturas muy bajas. A este proceso se le denomina condensación.
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
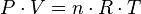
Donde:
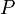
= Presión absoluta

= Volumen
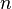
= Moles de gas
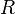
= Constante universal de los gases ideales
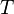
= Temperatura absoluta
Gases Reales
Un gas real, en opuesto a un gas ideal o perfecto, es un gas que exhibe propiedades que no pueden ser explicadas enteramente utilizando la ley de los gases ideales. Para entender el comportamiento de los gases reales, lo siguiente debe ser tomado en cuenta:
-efectos de compresibilidad;
-capacidad calorífica específica variable;
-fuerzas de Van der Waals;
-efectos termodinámicos del no-equilibrio;
-cuestiones con disociación molecular y reacciones elementales con composición variable.
Para la mayoría de aplicaciones, un análisis tan detallado es innecesario, y la aproximación de gas ideal puede ser utilizada con razonable precisión. Por otra parte, los modelos de gas real tienen que ser utilizados cerca del punto de condensación de los gases, cerca de puntos críticos, a muy altas presiones, y en otros casos menos usuales.
Para medir el comportamiento de un gas que difiere de las condiciones habituales del gas ideal, es necesario aplicar las ecuaciones de los gases reales. Estas demuestran que los gases realesno tienen una expansión infinita: de lo contrario, alcanzarían un estado en el que ya no podrían ocupar un volumen mayor.
El comportamiento de un gas real se asemeja al de un gas ideal cuando su fórmula química es sencilla y cuando se reactividad es baja. El helio, por ejemplo, es un gas real cuyo comportamiento es cercano al ideal.
Video
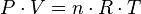
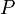 = Presión absoluta
= Presión absoluta = Volumen
= Volumen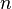 = Moles de gas
= Moles de gas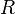 = Constante universal de los gases ideales
= Constante universal de los gases ideales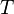 = Temperatura absoluta
= Temperatura absoluta


No hay comentarios:
Publicar un comentario